Αλλά λόγια να αγαπιόμαστε. Πάντα οι μικρές λεπτομέρειες με τις μεγάλες συνέπειες κάνουν τη διαφορά.
Με ένα tweet το οποίο, αν και εμφανώς θέλει να διασκεδάσει τις εντυπώσεις, χάνει σε ουσία, ο πρώην υπουργός Υγείας Αδωνης Γεωργιάδης επιχειρεί να αποδομήσει το ρεπορτάζ του Documento της περασμένης Κυριακής, για τις συνέπειες που είχε η τροποποίηση μιας διάταξης, το Σεπτέμβριο του 2013, επί υπουργίας του, αξιοποιούμενη από τη Novartis.
Μέχρι το Σεπτέμβριο του 2013, η προϋπόθεση για να μπουν στον θετικό κατάλογο τα λεγόμενα φάρμακα αναφοράς και φάρμακα για σοβαρές ασθένειες ήταν να καλύπτονται από τα ασφαλιστικά ταμεία «στα 2/3 των κρατών μελών της Ευρωπαϊκής Ένωσης ή τουλάχιστον σε 12 κράτη μέλη της Ευρωπαϊκής Ένωσης». Με την τροποποίηση τέθηκε προϋπόθεση να αποζημιώνονται «στα 2/3 των κρατών μελών της Ευρωπαϊκής Ένωσης στα οποία κυκλοφορούν ή τουλάχιστον σε 12 κράτη μέλη της Ευρωπαϊκής Ένωσης». Η προσθήκη των τριών λέξεων «…στα οποία κυκλοφορούν» είχε σημασία. Η διάταξη άλλαξε έξι μήνες αργότερα, αλλά στο μεταξύ είχε αξιοποιηθεί η προηγούμενη πρόβλεψη από τη Novartis με φαρμακευτικά της σκευάσματά να παίρνουν θέση στο δελτίο τιμών, αλλά και ως πανάκριβα νέα φάρμακα να εντάσσονται στον λεγόμενο θετικό κατάλογο προς αποζημίωση όπως το JAKAVI, το VOTUBIA, το SIGNIFOR και το TOBI Podhaler.
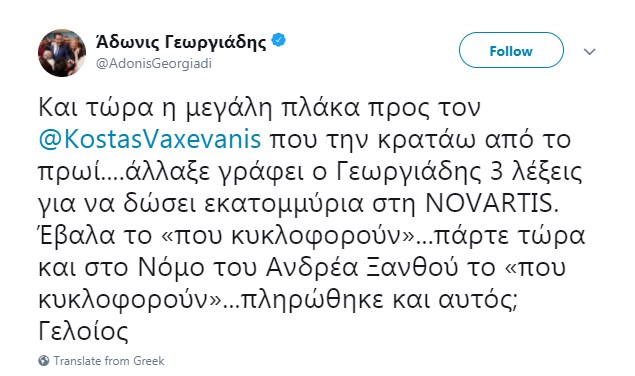
Και τώρα η μεγάλη πλάκα προς τον @KostasVaxevanis που την κρατάω από το πρωί….άλλαξε γράφει ο Γεωργιάδης 3 λέξεις για να δώσει εκατομμύρια στη NOVARTIS. Έβαλα το «που κυκλοφορούν»…πάρτε τώρα και στο Νόμο του Ανδρέα Ξανθού το «που κυκλοφορούν»…πληρώθηκε και αυτός; Γελοίος pic.twitter.com/iEXfoaUx8n
— Άδωνις Γεωργιάδης (@AdonisGeorgiadi) March 4, 2018
Και τώρα η μεγάλη πλάκα προς τον @KostasVaxevanis που την κρατάω από το πρωί….άλλαξε γράφει ο Γεωργιάδης 3 λέξεις για να δώσει εκατομμύρια στη NOVARTIS. Έβαλα το «που κυκλοφορούν»…πάρτε τώρα και στο Νόμο του Ανδρέα Ξανθού το «που κυκλοφορούν»…πληρώθηκε και αυτός; Γελοίος pic.twitter.com/iEXfoaUx8n
— Άδωνις Γεωργιάδης (@AdonisGeorgiadi) March 4, 2018
Ο πρώην υπουργός ρίχνει άδεια για να πιάσει γεμάτα γράφοντας στο twitter, παίζοντας με τις …λέξεις και χρησιμοποιώντας ως …επιχείρημα ότι οι τρεις λέξεις «που κυκλοφορούν» …υπάρχουν και στο «Νόμο του Ανδρέα Ξανθού». Δεν είναι έτσι. Με τη διάταξη του Σεπτεμβρίου του 2013 είχε τεθεί ως κριτήριο ένταξης στο θετικό κατάλογο αν το φάρμακο αποζημιώνεται στα 2/3 των χωρών που κυκλοφορεί . Μέχρι τότε για να μπει στη θετική λίστα έπρεπε να αποζημιώνεται στα δύο τρίτα των χωρών της Ευρωπαϊκής Ένωσης ή τουλάχιστον σε δώδεκα. Αυτό επανήλθε από τις 24.3.2014 (ΦΕΚ Α΄73) οπότε η παράγραφος 7 του άρθρου 21 του νόμου 4052/2012, αντικαταστάθηκε με την παράγραφο 6 του άρθρου 127 του ν. 4249/2014.
Τα κριτήρια αξιολόγησης φαρμάκων θετικού καταλόγου που τροποποιήθηκαν τον Μάιο του 2017 με το νόμο 4472/2017 (ΦΕΚ Α΄74/19.5.2017) , στον οποίο αναφέρεται ο Αδωνης Γεωργιάδης, τίθενται σωρευτικές προϋποθέσεις και όχι διαζευτικά. Άλλη μια μικρή λεπτομέρεια με μεγάλες συνέπειες και κυρίως με δύναμη αποδόμησης της επιφανειακής επιχειρηματολογίας του μέσω twitter . Το άρθρο 89 του Ν4472/2017 αναφέρει στην πρώτη παράγραφο:
«1. Η διάταξη της περίπτωσης β΄ της παρ.1 του άρθρου 12 του ν. 3816/2010 (Α΄6) αντικαθίσταται ως εξής:
«Για την κατάρτιση, την αναθεώρηση και τη συμπλήρωση του καταλόγου εφαρμόζεται σύστημα κατάταξης φαρμακευτικών προϊόντων, σύμφωνα με το σύστημα Ανατομικής Θεραπευτικής Χημικής Κατηγοριοποίησης (Anatomic Therapeutic Chemical Classification – ATC) του Παγκόσμιου Οργανισμού Υγείας (Π.Ο.Υ.) και εισάγεται σύστημα τιμών αναφοράς (Τ.Α.) ανά κατηγορία φαρμακευτικών προϊόντων. Ο Ε.Ο.Π.Υ.Υ. και οι Φ.Κ.Α. αποζημιώνουν τα φάρμακα που τελούν σε περίοδο προστασίας των δεδομένων τους ως προς τη δραστική τους ουσία και έχουν πάρει άδεια κυκλοφορίας, σύμφωνα με την εθνική διαδικασία ή την αποκεντρωμένη διαδικασία ή την διαδικασία αμοιβαίας αναγνώρισης ή την κεντρική διαδικασία του Κανονισμού 726/2004/ΕΚ (EE L 136), εφόσον πληρούνται σωρευτικά οι ακόλουθες προϋποθέσεις: 1) Αποζημιώνονται τουλάχιστον στα δύο τρίτα (2/3) των κρατών-μελών της Ευρωπαϊκής Ένωσης που κυκλοφορούν, τα κράτη στα οποία κυκλοφορούν δεν μπορεί να είναι λιγότερα από εννέα (9) και από τα ανωτέρω κράτη που αποζημιώνουν το φάρμακο, τουλάχιστον τα μισά περιλαμβάνονται στα κάτωθι ειδικώς αναφερόμενα κράτη-μέλη που διαθέτουν μηχανισμό Αξιολόγησης Τεχνολογιών Υγείας για τα φάρμακα ανθρώπινης χρήσης, ήτοι: η Αυστρία, το Βέλγιο, η Μεγάλη Βρετανία, η Γαλλία, η Ισπανία, η Ολλανδία, η Πορτογαλία, η Σουηδία και η Φινλανδία και 2) Λαμβάνουν θετική αξιολόγηση από την Επιτροπή της περίπτωσης γ΄ της παρούσας παραγράφου, δυνάμει κριτηρίων τεχνολογιών υγείας, εφαρμοζόμενων σε συνδυασμό μεταξύ τους, τα οποία είναι: α) Η ανεκπλήρωτη ιατρική ανάγκη, β) η προστιθέμενη θεραπευτική αξία του υπό αξιολόγηση φαρμακευτικού προϊόντος σε σχέση με τις υφιστάμενες θεραπείες, γ) η αξιοπιστία και η αντιπροσωπευτικότητα των στοιχείων κλινικής τεκμηρίωσης και δ) η σχέση κόστους-οφέλους ή αποτελεσματικότητας μετά από συνεκτίμηση των δημοσιονομικών επιπτώσεων στη δημόσια φαρμακευτική δαπάνη σε συνάρτηση με τα φαρμακοεπιδημιολογικά και φαρμακοοικονομικά δεδομένα της χώρας. Σε περίπτωση που η Επιτροπή της περίπτωσης γ΄ της παρούσας παραγράφου εκτιμά ότι ένα προϊόν δεν ανταποκρίνεται στο τελευταίο κριτήριο κόστους οφέλους ή αποτελεσματικότητας, το παραπέμπει στην Επιτροπή Διαπραγμάτευσης του άρθρου 3 του ν. 4208/2013 (Α΄252) και εκδίδει την εισήγησή της προς τον Υπουργό μόνον μετά από επιτυχή κατάληξη της διαδικασίας διαπραγμάτευσης. Η προϋπόθεση της περίπτωσης 2 των προηγούμενων εδαφίων της παρούσας, εφαρμόζεται για όλα τα φάρμακα που θα ενταχθούν στην θετική λίστα, ανεξαρτήτως εάν βρίσκονται σε περίοδο προστασίας των δεδομένων τους ή όχι και επίσης εφαρμόζεται για την αναθεώρηση του θετικού καταλόγου. H Επιτροπή της περίπτωσης γ΄ της παρούσας παραγράφου αποφασίζει για τις θεραπευτικές ενδείξεις, τις γραμμές θεραπείας, τις περιεκτικότητες και τις συσκευασίες, για τις οποίες αποζημιώνονται τα φαρμακευτικά προϊόντα που εντάσσονται στο θετικό κατάλογο, μετά από την αξιολόγησή τους δυνάμει των ανωτέρω κριτηρίων. Προκειμένου να αποζημιωθεί θεραπευτική ένδειξη φαρμάκου, επιπρόσθετη και διάφορη της μίας ή των περισσότερων θεραπευτικών ενδείξεων για τις οποίες έχει ενταχθεί στο θετικό κατάλογο απαιτείται η υποβολή προηγούμενης αίτησης από μέρους του Κατόχου Άδειας Κυκλοφορίας και η αξιολόγησή του από την Επιτροπή με βάση τα ανωτέρω κριτήρια. Με απόφαση του Υπουργού Υγείας, μετά από γνώμη της Επιτροπής της περίπτωσης γ΄ της παρούσας παραγράφου μπορούν να εξαιρούνται από τα κριτήρια της ως άνω περίπτωσης 1) του δευτέρου εδαφίου της παρούσας, φάρμακα τα οποία έχουν λάβει άδεια κυκλοφορίας ως ορφανά, ή φάρμακα για την θεραπεία της μεσογειακής αναιμίας, μόνο εφόσον καλύπτονται από διεθνή κλινικά πρωτόκολλα και λαμβάνουν θετική αξιολόγηση σύμφωνα με τα κριτήρια της ως άνω περίπτωσης 2 του δευτέρου εδαφίου της παρούσας. Με απόφαση του Υπουργού Υγείας, μετά από γνώμη της Επιτροπής της περίπτωσης γ΄ της παρούσας, η οποία δημοσιεύεται στην Εφημερίδα της Κυβερνήσεως, αναρτάται στην ιστοσελίδα του Ε.Ο.Φ. και δεν μπορεί να εκδοθεί πριν την 1.6.2018, δύναται να αναθεωρείται ο προαναφερόμενος κατάλογος των χωρών της Ε.Ε. που διαθέτουν μηχανισμό Αξιολόγησης Τεχνολογιών Υγείας. Η έκδοση νέας, μετά την πρώτη, υπουργικής απόφασης του προηγούμενου εδαφίου επιτρέπεται μόνο μετά την παρέλευση ενός έτους από την έκδοση και δημοσίευση της τελευταίας υπουργικής απόφασης με το ίδιο αντικείμενο. Με όμοια απόφαση, εξειδικεύεται ο τρόπος κατάρτισης των θεραπευτικών κατηγοριών και προσδιορισμού των τιμών αναφοράς ανά θεραπευτική κατηγορία και οι διαδικασίες αναθεώρησης και συμπλήρωσης του καταλόγου, καθώς και οι αποζημιούμενες ενδείξεις, γραμμές θεραπείας, περιεκτικότητες και συσκευασίες ανά φαρμακευτικό προϊόν και κάθε άλλο σχετικό θέμα. Κατά τα λοιπά και έως την έκδοση της απόφασης του προηγούμενου εδαφίου της παρούσας, εφαρμόζονται οι ισχύουσες κανονιστικές πράξεις (…).».